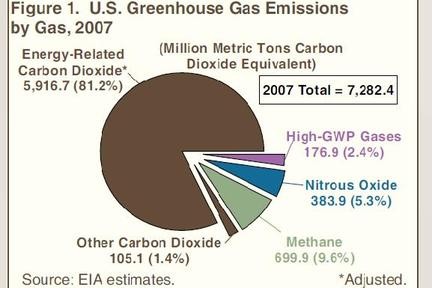
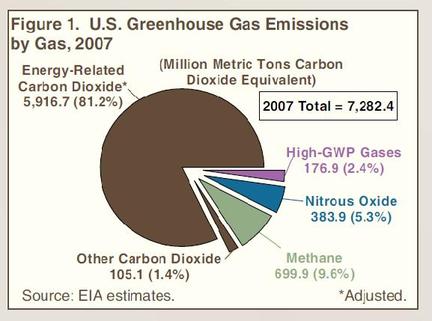
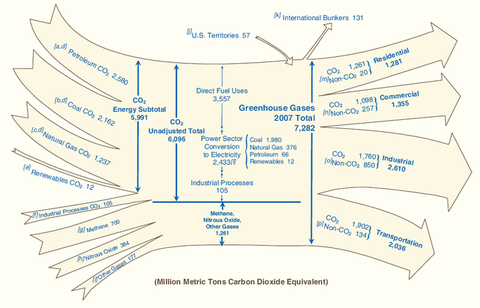
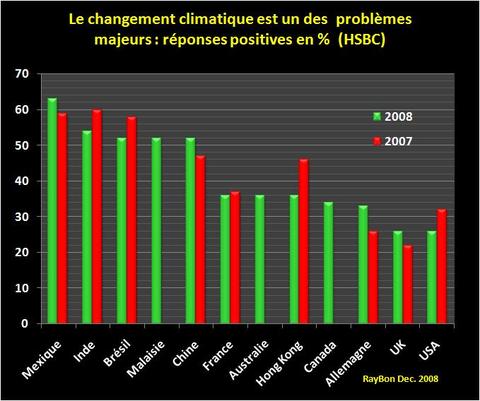
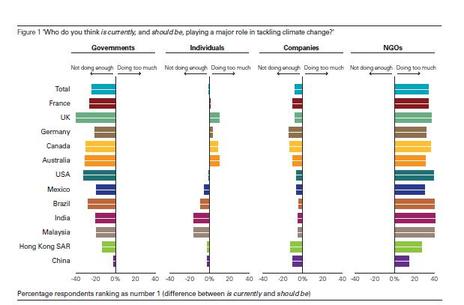
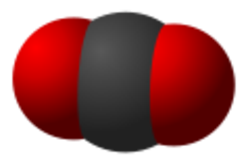
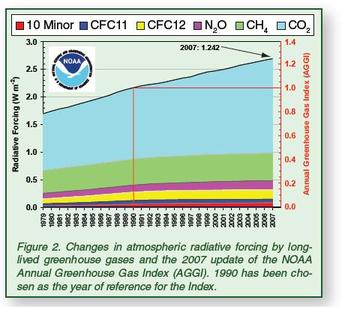
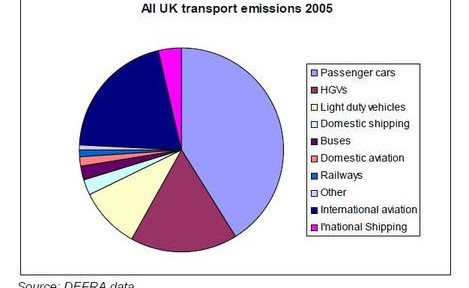
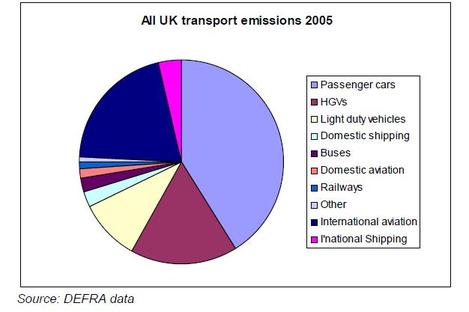
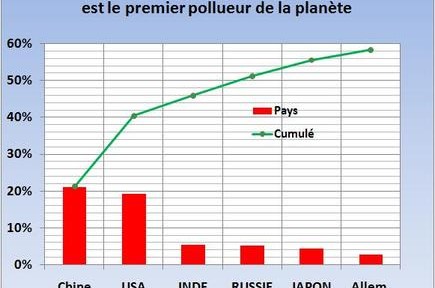
Lorsque j’allume mon fourneau à gaz pour y faire mijoter le plat du jour, j’utilise l’oxydation du méthane au contact de l’oxygène de l’air qui en formant de la vapeur d’eau et du CO2 génère de la chaleur. Ce que sait faire le commun des mortels dans un sens, le chimiste sait le refaire dans l’autre sens avec quelques tours de mains et de l’énergie. Partant du CO2 on peut refaire, très chèrement, du méthane. Mais il est intéressant de retracer toutes les étapes de réduction possibles, électron par électron, pour aller du CO2 au CH4 et d’identifier les grandes familles de produits par lesquelles passe ce chemin. Le CO2 est la forme la plus oxydée du carbone, avec la version militarisée chlorée que constitue le phosgène (FIG.), obtenu par l’action du chlore sur me monoxyde de carbone et puissant intermédiaire de synthèse de certains polymères dont les polycarbonates (Makrolon, Plexiglass, etc.).
.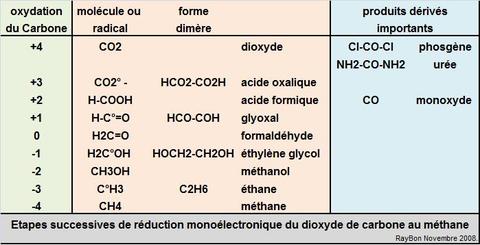
La première étape de réduction du CO2 à un électron conduit au radical anion CO2°– qui va se dimériser pour former la forme stable qu’est l’ion oxalate, la deuxième étape conduira à l’acide formique, la troisième à la forme dimère qu’est le glyoxal et ainsi de suite. On le voit, il y a dans les produits de réduction du CO2 des intermédiaires prestigieux comme le formol, l’éthylène glycol ou le méthanol.
Une des grandes utilisations du CO2 réside aujourd’hui dans la version agricole de l’ammoniac qu’est l’urée obtenue par réaction de l’ammoniac sur le CO2. On en fabrique chaque année plus de 100 millions de tonnes. De plus l’urée a une nouvelle application avec la réduction catalytique des oxydes d’azotes des gaz d’échappement de tous les gros camions européens modernes qui consomment l’Adblue, une solution à 33% d’urée dans de l’eau déionisée. Chaque camion consomme 500 g d’urée aux cent kilomètres environ (LIRE).
Les solvants utilisés dans les batteries Li-Ion pour former l’électrolyte comprennent des solvants qui sont des carbonates de composés éthyléniques obtenus par réaction de l’oxyde sur du CO2. Ces solvants sont appelés à une large utilisation avec l’accroissement du marché des voitures électriques.
L’Institut japonais pour l’Advanced Industrial Science and Technology (AIST) travaille sur les polypropylènes carbonates (PPC) obtenus par réaction de l’oxyde de propylène sur le CO2. Ils obtiennent des produits dignes d’intérêt avec de très forts modules d’élasticité par copolymérisation de ces produits avec d’autres polymères de types polyester.
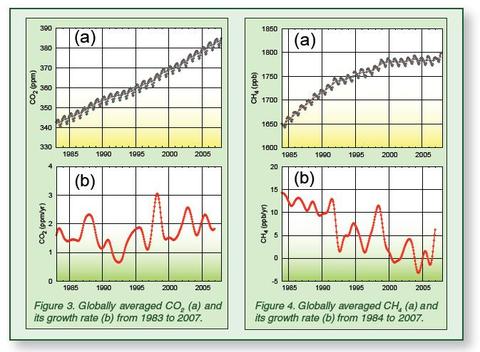
On peut donc imaginer une chimie partant du CO2 ou utilisant en partie le CO2. Mais ce n’est pas elle qui absorbera les 34 milliards de tonnes de CO2 larguées chaque année dans l’azur de notre planète, surtout que ce CO2 n’est qu’un intermédiaire de synthèse qui se retrouvera un jour ou l’autre émis à nouveau dans l’atmosphère.
Mais certains, à l’Université de Columbia, étudient une chimie plus grandiose telle que la réaction du CO2 avec certaines roches naturelles issues du magma profond, comme la péridotite trouvée à Oman. Elle réagit rapidement avec le CO2 pour former une roche calcaire. Des forages injectant du CO2 dans ce type de roche après fragmentation, permettrait de se débarrasser ad vitam de ce centaines de milliers de tonnes de ce déchet gênant. Encore faudrait-il que la péridotite ne soit pas très loin des unités industrielles, mais c’est une autre histoire.
Le 24 Novembre 2008.
–
 L‘Administration américaine, dans le cadre d’une reprise des investissements dans l’électronucléaire, a prévu de pouvoir garantir jusqu’à deux milliards de dollars de prêts à ceux qui désirent installer aux USA une unité d’enrichissement d’Uranium par centrifugation. Pour l’instant deux candidats sont dans la course: d’une part USEC, le premier fournisseur en Uranium enrichi des unités américaines avec plus de 50% de parts de ce marché et qui désire installer une nouvelle unité de production dans l’Ohio; d’autre part AREVA qui vient de déposer auprès du Department of Energy, la deuxième partie d’une demande de garantie de prêt concernant un projet d’une unité d’enrichissement qui serait implantée à Eagle Rock dans l’Idaho. Cette obtention d’une garantie des futurs prêts consentis au projet, est la méthode traditionnelle de contrôle du gouvernement américain sur les grands projets énergétiques. Par la suite il faudra qu’AREVA fasse une demande de Licence Combinée (COL) de construction et d’exploitation auprès de l’autorité de régulation nucléaire (NRC). L’ensemble de ces procédures peut parfois nécessiter plusieurs années pour aboutir. A suivre..!
L‘Administration américaine, dans le cadre d’une reprise des investissements dans l’électronucléaire, a prévu de pouvoir garantir jusqu’à deux milliards de dollars de prêts à ceux qui désirent installer aux USA une unité d’enrichissement d’Uranium par centrifugation. Pour l’instant deux candidats sont dans la course: d’une part USEC, le premier fournisseur en Uranium enrichi des unités américaines avec plus de 50% de parts de ce marché et qui désire installer une nouvelle unité de production dans l’Ohio; d’autre part AREVA qui vient de déposer auprès du Department of Energy, la deuxième partie d’une demande de garantie de prêt concernant un projet d’une unité d’enrichissement qui serait implantée à Eagle Rock dans l’Idaho. Cette obtention d’une garantie des futurs prêts consentis au projet, est la méthode traditionnelle de contrôle du gouvernement américain sur les grands projets énergétiques. Par la suite il faudra qu’AREVA fasse une demande de Licence Combinée (COL) de construction et d’exploitation auprès de l’autorité de régulation nucléaire (NRC). L’ensemble de ces procédures peut parfois nécessiter plusieurs années pour aboutir. A suivre..!