Robert Dopp, de Quantum Sphère Energy, a réussi à obtenir de l’hydrogène par électrolyse d’une solution aqueuse de potasse avec d’excellents rendements énergétiques, sous une densité de courant allant jusqu’à 5A /cm2 pour une tension remarquablement faible de 1,59 Volts. Ce résultat a été obtenu en alliant une technologie: l’électrolyse en lit fluidisé qui permet de réaliser la réaction en 3D, à un catalyseur Ni/Fe de très grande surface spécifique appelé "nanocatalyseur". L’alliance des propriétés électrochimiques de ce catalyseur en poudre et de la technologie en lit fluidisé permet de réaliser un véritable saut technologique dans l’obtention d’hydrogène par électrolyse avec une consommation de 42 kWh par kg d’hydrogène.
Robert Dopp, de Quantum Sphère Energy, a réussi à obtenir de l’hydrogène par électrolyse d’une solution aqueuse de potasse avec d’excellents rendements énergétiques, sous une densité de courant allant jusqu’à 5A /cm2 pour une tension remarquablement faible de 1,59 Volts. Ce résultat a été obtenu en alliant une technologie: l’électrolyse en lit fluidisé qui permet de réaliser la réaction en 3D, à un catalyseur Ni/Fe de très grande surface spécifique appelé "nanocatalyseur". L’alliance des propriétés électrochimiques de ce catalyseur en poudre et de la technologie en lit fluidisé permet de réaliser un véritable saut technologique dans l’obtention d’hydrogène par électrolyse avec une consommation de 42 kWh par kg d’hydrogène.
(voir les publications de R.D. sur le sujet 2007 et 2006)
Mais pour juger de l’efficacité énergétique globale de la filière hydrogéne encore faut-il examiner chacune des étapes du processus de l’électrolyseur à la sortie de la pile à combustible.
L’électrolyse de l’eau: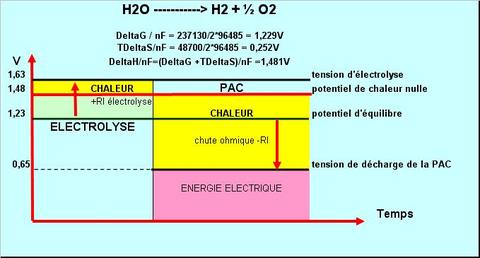 la réaction est endothermique. A partir de l’enthalpie DeltaH il est possible de calculer le potentiel de chaleur nulle de la réaction électrochimique qui est égal à 1,48V à 25°C. Il est supérieur de 0,25V au potentiel d’équilibre de la réaction qui est de 1,23V. A partir de cette valeur de tension on retrouve aisément les rendements annoncés par Dopp en fonction des tensions d’électrolyse. Une valeur de rendement énergétique de 75% est obtenu avec une tension de 1,743V en effet 1,48/1,743=0,75. De la même façon on calcule un rendement de 93% avec une tension d’électrolyse en lit fluidisé de 1,59V.
la réaction est endothermique. A partir de l’enthalpie DeltaH il est possible de calculer le potentiel de chaleur nulle de la réaction électrochimique qui est égal à 1,48V à 25°C. Il est supérieur de 0,25V au potentiel d’équilibre de la réaction qui est de 1,23V. A partir de cette valeur de tension on retrouve aisément les rendements annoncés par Dopp en fonction des tensions d’électrolyse. Une valeur de rendement énergétique de 75% est obtenu avec une tension de 1,743V en effet 1,48/1,743=0,75. De la même façon on calcule un rendement de 93% avec une tension d’électrolyse en lit fluidisé de 1,59V.
La Pile à combustible: C’est la réaction inverse de la réaction d’électrolyse qui se produit, elle est donc exothermique (surface jaune entre 1.23V et 1.48V) et se rajoute la chute ohmique à l’intérieur de la pile et de ses membranes permsélectives de séparation des réactions. Le rendement électrique d’une PAC est donc mauvais, un peu meilleur que celui d’un moteur à explosion à faible régime de courant et très mauvais en cas d’appel important de courant. Par exemple pour une tension de fonctionnement de la pile de 0,65V le rendement est de 0,65/1,48 = 44%.
Prenons un exemple d’une électrolyse réalisée à 1,63V,sous forte agitation en lit fluidisé, l’hydrogène produit est récupéré et séparé des traces de solution de potasse, puis il est conditionné sous pression sous forme d’hydrure métallique par exemple, puis il est utilisé sur un véhicule pour alimenter une PAC. Examinons la cascade d’opérations avec les rendements de chacune: électrolyse 91%, fonctionnement de l’électrolyseur (pompes, régulations, vannes, etc.) 92%, collecte et séchage du gaz 98%, conditionnement exothermique sous pression 85%, rendement de la PAC 44%. A partir des tensions d’électrolyse 1,63V et de fonctonnement de la PAC à 0,65V le ratio 0.65/1.63 donne un rendement électrochimique de 40%, mais si on ajoute toutes les pertes associées le rendement tombe à 30%.
Examinons la cascade d’opérations avec les rendements de chacune: électrolyse 91%, fonctionnement de l’électrolyseur (pompes, régulations, vannes, etc.) 92%, collecte et séchage du gaz 98%, conditionnement exothermique sous pression 85%, rendement de la PAC 44%. A partir des tensions d’électrolyse 1,63V et de fonctonnement de la PAC à 0,65V le ratio 0.65/1.63 donne un rendement électrochimique de 40%, mais si on ajoute toutes les pertes associées le rendement tombe à 30%.
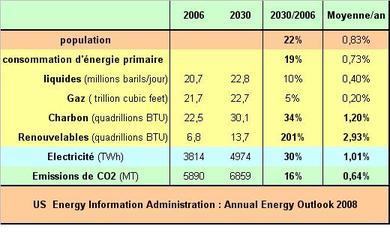
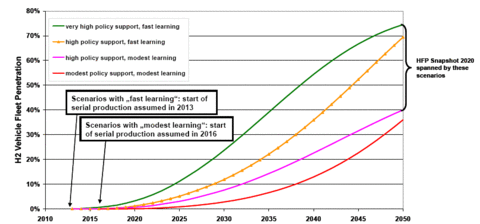
En conclusion: il faut fournir plus de trois fois plus d’énergie à l’électrolyseur qu’il n’en est récupéré à la sortie de la PAC à bord du véhicule. On le voit, le véhicule électrique à Hydrogène est destiné a une classe dirigeante riche et qui dispose d’énergie non polluante à volonté. Les hypothèses européennes de quasi généralisation à l’horizon 2050 sont des vues de l’esprit. Mais, me direz-vous, il y a 50 ans tout le monde ou presque admettait qu’en l’an 2000 on se déplacerait avec un hélicoptère personnel et portable. Le principal concurrent de la PAC est le moteur à explosion alimenté en hydrogène, il sera infiniment moins complexe à entretenir pour un rendement du même ordre.
 Derrière les bla-bla écologiques des autorités centrales chinoises et les réalisations de prestige des riches Provinces côtières, il y a la dure réalité des Provinces reculées, du Centre ou de l’Ouest, plus grandes et plus peuplées que n’importe quel pays européen, et qui construisent à tout va, faute de ressources financières et technologiques, les vieux modèles de centrales électriques soviétiques des années 50. Alors Maximillien Haufhammer de Berkeley et Richard Carson de San Diego ont fait une étude Province par Province des émissions de CO2 des 30 entités de la Chine entre 1985 et 2004. Le résultat est un tableau de 588 observations. Alors que les estimations précédentes tablaient sur une croissance annuelle des émissions de 2.5 à 5%, leur travail analytique indique un résultat explosif de 11% de croissance annuelle des émissions de CO2 chinoises. En 2010 les émissions de CO2 dépasseront au minimum de 600 millions de tonnes celles de l’an 2000. Elles effaceront les pauvres 116 millions de tonnes économisées dans les pays ayant signé le protocole de Kyoto. La croissance des émissions de CO2 de la Chine en 10 ans sera supérieure à la totalité des émissions de l’Allemagne.
Derrière les bla-bla écologiques des autorités centrales chinoises et les réalisations de prestige des riches Provinces côtières, il y a la dure réalité des Provinces reculées, du Centre ou de l’Ouest, plus grandes et plus peuplées que n’importe quel pays européen, et qui construisent à tout va, faute de ressources financières et technologiques, les vieux modèles de centrales électriques soviétiques des années 50. Alors Maximillien Haufhammer de Berkeley et Richard Carson de San Diego ont fait une étude Province par Province des émissions de CO2 des 30 entités de la Chine entre 1985 et 2004. Le résultat est un tableau de 588 observations. Alors que les estimations précédentes tablaient sur une croissance annuelle des émissions de 2.5 à 5%, leur travail analytique indique un résultat explosif de 11% de croissance annuelle des émissions de CO2 chinoises. En 2010 les émissions de CO2 dépasseront au minimum de 600 millions de tonnes celles de l’an 2000. Elles effaceront les pauvres 116 millions de tonnes économisées dans les pays ayant signé le protocole de Kyoto. La croissance des émissions de CO2 de la Chine en 10 ans sera supérieure à la totalité des émissions de l’Allemagne.