L’homme, nous dit-on, produit trop de gaz à effet de serre et parmi ceux-ci trop de CO2. Les activités humaines industrielles et agricoles conduiraient chaque année à la formation d’environ 35 milliards de tonnes de CO2 dont une moitié se retrouve dans l’atmosphère, l’autre moitié étant absorbée par les plantes, les eaux douces et les océans qui peu à peu deviennent plus acides malgré le boulot des diatomées qui s’en nourrissent. Les remèdes imaginés à ce jour pour limiter ces émissions reposent sur deux piliers principaux:
1- limiter les émissions de CO2 par une meilleure efficacité énergétique et si possible, par une sélection des ressources primaires: c’est une décision facile à formuler mais beaucoup plus difficile à mettre en musique surtout lorsque les principaux émetteurs, la Chine et les États-Unis, ne veulent pas mettre en balance leur développement économique. Il faut donc prévoir des émissions de gaz carbonique qui vont croître avec le développement de l’économie mondiale durant les décennies à venir, malgré les multiples congrès internationaux clamant qu’elles vont décroître…promesses d’ivrognes.
2-l’autre option est de capter les émissions de gaz à la sortie des chaudières industrielles et de valoriser cette ressource. Bien sûr l’enfouissement dans des aquifères largement promue par les instances comme l’IEA, est la dernière option à adopter…puisqu’elle n’apporte rien à l’économie mondiale, sinon une dépense d’énergie supplémentaire et donc un appauvrissement. La première utilisation qui devrait absorber utilement des milliards de tonnes de CO2 est la récupération assistée des réserves de pétrole (EOR) des « Residual Oil Zone » dans les puits en phase d’épuisement. C’est une voie qui avec l’accroissement des prix du pétrole va trouver sa pleine rentabilité…dans les grandes régions d’exploitation du pétrole tramées de gazoducs « carboniques ». L’autre voie repose sur la chimie du CO2.
Je voudrais ici apporter un simple éclairage de ce qui pourrait être une amorce de chimie du CO2 qui bien sûr pourra se décliner en de multiples procédés plus ou moins pertinents.
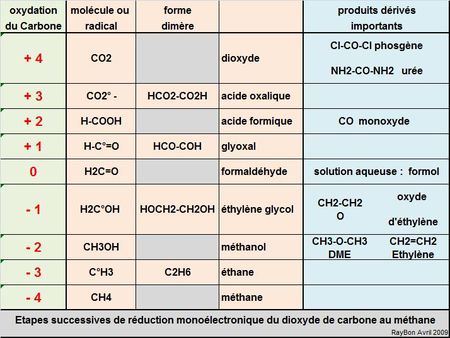
Mais tout d’abord quels sont les produits à attendre de cette filière à développer. Pour cela il est utile d’aborder méthodiquement cette chimie à partir des étapes de réduction mono-électroniques successives de la forme la plus oxydée du Carbone qu’est le dioxyde de carbone pour aller vers la forme la plus réduite: le Méthane (FIG.).
La fourniture du premier électron, du troisième, du cinquième et du septième conduit dans ce schéma simple à la formation d’une nouvelle espèce radicalaire qui spontanément se dimérise. C’est la raison pour laquelle apparaissent successivement et de façon contre-intuitive l’acide oxalique, le glyoxal, l’éthylène glycol et l’éthane dans les produits de réduction. Pour les nombres pairs d’électrons apportés au CO2 ce sont les formes monomères que sont l’acide formique, le formaldéhyde, le méthanol et le méthane qui sont stables.
Il est alors possible, fort de cette nomenclature, d’examiner produit par produit ce à quoi la chimie raisonnée du CO2 pourrait conduire.
1- la forme oxydée : il ne faut tout d’abord pas oublier deux produits majeurs dérivés du CO2 que sont:
–le phosgène Cl-CO-Cl formidable intermédiaire majeur de synthèse de la chimie organique (isocyanates, polyuréthanes, polycarbonates,…) obtenu par réaction du monoxyde de carbone CO avec le chlore,
–l’urée NH2-CO-NH2 engrais majeur et plus marginalement réducteur des NOx dans les gaz d’échappement des véhicules (AD-BLUE) qui est obtenu par la réaction de l’ammoniac sur le CO2. La production d’urée est le premier exemple de la chimie du CO2. C’est le japonais MHI qui est le N° 1 mondial dans la maîtrise de ce procédé qui part du méthane pour produire du CO2 et de l’hydrogène. Le CO2 est d’abord capté puis utilisé dans la réaction avec l’ammoniac qui a été synthétisé auparavant à partir de l’hydrogène. C’est un modèle à suivre.
-le dioxyde de carbone est également utilisé dans la synthèse d’une classe de solvants organiques en pleine expansion de types carbonate d’éthylène (EC) et autres produits substitués qui sont largement utilisés dans la formulation des électrolytes des accumulateurs Li-Ion. Ce marché annuel des électrolytes représentait en 2010 dans 20 mille tonnes de mélanges complexes. Il atteindra en 2015, grâce au développement des véhicules électriques, dans les 40 à 60 mille tonnes. Le japonais UBE et l’américain Dow Chemical viennent d’annoncer la création d’une JV pour accélérer la croissance des productions d’électrolytes constitués de solvants et de sels fluorés anhydres. Cette JV sera progressivement développée aux Etats-Unis, en Europe et en Chine affirme le Nikkei.
2- l’acide oxalique: on peut imaginer un procédé électrochimique ou chimique simple qui par une réduction mono-électronique conduirait au radical anion CO2°–, lequel en se dimérisant conduit à l’anion oxalate. La principale utilisation de l’acide oxalique est très actuelle puisqu’elle sert essentiellement en Chine à récupérer et séparer les terres-rares après chélation. Le marché mondial de cet acide est estimé autour de 200 millions de tonnes. Le développement de l’utilisation des terres-rares et de leur extraction en dehors de Chine ouvre la voie à un marché pour ce produit.
3-l’acide formique et son dérivé majeur le monoxyde de carbone:
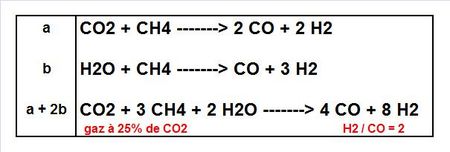
Outre les élégants travaux d’Ishitani tentant de réduire le CO2 en monoxyde par des voies photochimiques inspirées des réactions enzymatiques naturelles, la chimie des mélanges naturels ou non de CO2 et de méthane est sûrement une voie d’avenir majeure pour arriver au syngas et donc aux carburants liquides synthétiques via les procédés de type Fischer-Tropsch. Nous avons rendu-compte ici des remarquables travaux japonais sur le sujet destinés à valoriser des gisements de gaz naturel très riches en CO2 selon le schéma:
Le CO2 réduit par le méthane (réaction a) conduit à un gaz de synthèse proche du gaz à l’eau (réaction b). Il y a dans ces réactions le schéma d’une future voie GTL très rentable de synthèse des carburants liquides. Le CO2 peut provenir du gisement de gaz naturel soit être volontairement rajouté au gaz pour atteindre la composition de gaz de synthèse désirée.
Dans un contexte à venir où les carburants de synthèse constitueront une part significative des approvisionnements du marché (10% à 20%), il faut imaginer des milliards de tonnes de CO2 impliquées dans ces synthèses.
4- le glyoxal: ce produit ne semble guère passionner les chimistes aujourd’hui.
5- le formaldéhyde: il est à la base de nombreuses résines (urée-formol, mélamines) et autres polyoxyméthylènes c’est un des grands intermédiaires de la chimie organique.
6- l’éthylène glycol et son dérivé l’oxyde d’éthylène qui constitue un des grands intermédiares de la pétrochimie et plus largement de la chimie organique. La chimie du CO2 qui conduirait à ces trois derniers produits présenterait un intérêt économique évident.
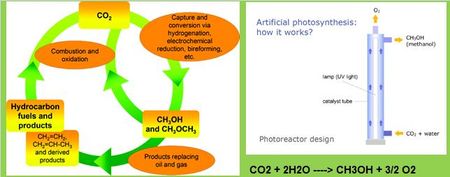
7- le méthanol: c’est paradoxalement le produit qui fait le plus fantasmer les prévisionnistes de l’énergie alors qu’il faut tout de même 6 électrons pour l’obtenir. Certains parlent même d’Économie du Méthanol…plus c’est gros plus ça impressionne. Tout cela est bien joli mais encore faudrait-il définir des procédés de production rentables.
Une voie semble cependant attrayante: la conversion directe du CO2 en présence d’eau en méthanol et oxygène par voie photochimique sur catalyseurs étudiée en particulier par Nazimek de l’Université Marie Curie de Lublin. Mais pour recueillir tout l’intérêt d’un tel procédé photo-catalytique il faudrait traiter directement les gaz de combustion à la sortie des chaudières et s’affranchir ainsi du captage du CO2.
8 et 9- les alcanes: produire de l’éthane ou du méthane par hydrogénation du gaz carbonique semble bien peu attrayant et non rentable. Pour utiliser l’Hydrogène électrolytique produit par les éoliennes en heure creuse autant l’injecter directement dans le réseau de gaz naturel comme le proposent les ingénieurs de Siemens.
En conclusion il apparaît que la chimie du CO2 est une option importante de valorisation de la ressource qui entrera en compétition avec la récupération lucrative du pétrole des « Residual Oil Zone ». Les bons procédés seront ceux qui maîtriseront au mieux le niveau de réduction de la ressource, sans forcément aller jusqu’au méthanol.
Le 10 Juillet 2011

Laisser un commentaire