L’électrolyse de l’eau revient à la mode comme procédé de production d’hydrogène à partir de puissance électrique fatale issue d’éoliennes et cellules photovoltaïques installées en surnombre et à grands frais dans le Nord de l’Europe. Partir de la molécule d’eau, exemplaire pour sa stabilité thermodynamique, pour en extraire l’hydrogène n’est pas forcément un optimum énergétique. Mais l’abondance de la ressource, son faible coût, la disponibilité de puissance électrique excédentaire peuvent justifier la mise en œuvre de ce procédé pour produire de l’hydrogène qui sera injecté dans les réseaux de gaz naturel ou mis en bouteille, en concurrence avec l’hydrogène issu du reformage du gaz naturel, pour alimenter les nouvelles piles à combustible embarquées sur de luxueux et onéreux véhicules de transport terrestre nippons ou coréens (en attendant les copies européennes toujours en retard) . Cette électrolyse de rattrapage n’est pas la révolution énergétique claironnée par certains baratineurs qui vous titillent l’émotion, c’est tout au plus un procédé marginal de récupération partielle d’énergie renouvelable disponible en excès.
Une des clés de la maîtrise de la réaction d’électrolyse de l’eau repose sur celle de la réaction d’évolution d’hydrogène (HER pour les américains). En effet sur bien des électrodes de diverses natures la réaction de réduction de l’eau donne lieu à des phénomènes de surtensions importantes, et donc à des pertes d’énergie sous forme de chaleur qui dégradent le bilan énergétique de l’opération. Le métal idéal pour réaliser la réduction de la molécule d’eau est le platine dont le défaut essentiel est constitué dans ce cas par son prix.
Toute avancée dans la recherche de substituts au platine, que ce soit dans l’électrolyse de l’eau ou dans les piles à combustible, on parle alors dans ce cas d’oxydation d’hydrogène, présente un intérêt majeur dans le mouvement de démocratisation de ces technologies complexes et onéreuses.
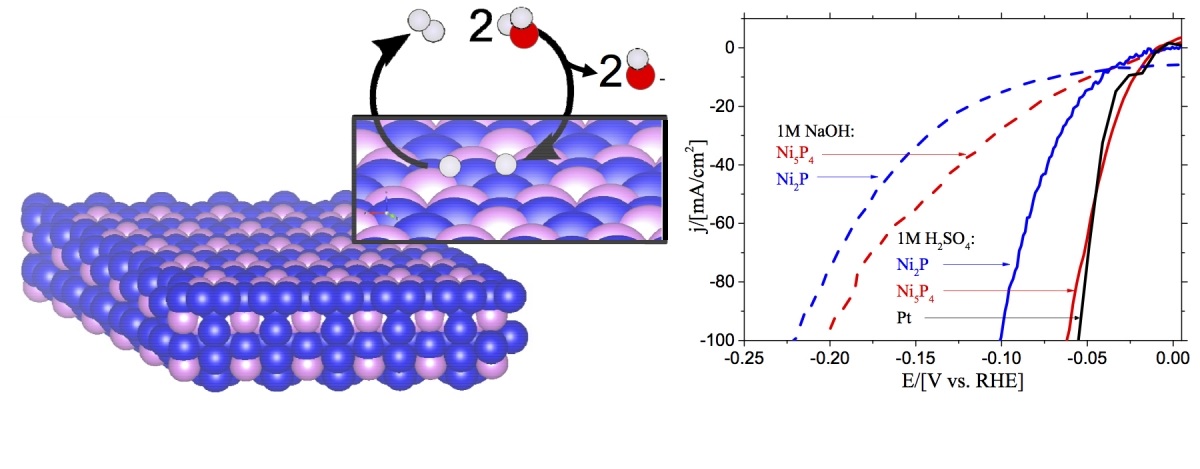
A ce titre les courbes intensité-potentiel de réduction de l’eau, présentées récemment par Brian Scheid sur une électrode de phosphure de nickel Ni5P4, comparées à celles obtenues sur électrode de platine sont particulièrement impressionnantes (FIG.).
ACCEDER au papier concernant cette nouvelle.
Le 24 Mars 2015
Laisser un commentaire