La littérature sur les piles à combustibles, science d’un grand âge, jalonnée de Professeurs Nimbus plus ou moins honnêtes et depuis disparus, est truffée d’approximations, sinon de pieux mensonges par omissions. Quelle que soit la façon dont vous synthétiserez 18g d’eau à partir de 16g d’oxygène et 2 gramme d’hydrogène vous obtiendrez toujours la même quantité d’énergie qui est donnée par l’enthalpie de la réaction. Par combustion vous n’obtiendrez que de la chaleur et à l’aide d’une pile à combustible de type PEM (membrane échangeuse de protons) par exemple, vous obtiendrez un mix d’énergie électrique et d’énergie thermique, la somme des deux étant constante et égale à l’enthalpie de la réaction. 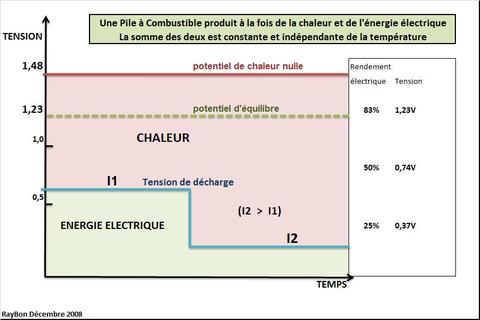
Le passage de la thermodynamique à l’électrochimie et ses tensions se fait par la Loi de Nernst qui définit le potentiel d’équilibre d’une réaction comme le rapport entre l’Energie libre de la réaction et le produit du nombre d’électrons mis en jeu par le Faraday (Eeq=DeltaG/zF). Par analogie et pour représenter graphiquement les phénomènes thermiques il est intéressant de définir le potentiel de chaleur nulle qui est égal à (DeltaH/2F) où Delta H est l’enthalpie de la réaction d’électrolyse de l’eau, 2 le nombre d’électrons mis en jeu par molécule d’eau et F le Faraday (TAB.). Ce potentiel représente la tension d’électrolyse de l’eau à partir de laquelle la réaction électrochimique va être exothermique. Dans le cas de l’électrolyse de l’eau cette tension va être au dessus de la tension d’équilibre, la réaction d’électrolyse étant endothermique.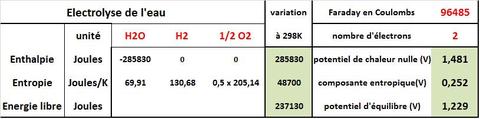
La réaction inverse de synthèse de l’eau dans la pile à combustible va obéir aux mêmes lois, au signe près. Le rendement électrique de la pile sera alors simplement défini comme le rapport entre la tension de la pile pour un courant donné et le potentiel de chaleur nulle représentant le DeltaH de la réaction de formation de l’eau par simple combustion. On voit (FIG.) que pour une tension de 0,74V, à faible courant, le rendement est de 50% et que pour une tension de 0,5V, habituelle à courant fort, le rendement est voisin de 33%.
Le rendement ne peut pas excéder 83%, rapport entre le potentiel d’équilibre et le potentiel de chaleur nulle. Les 17% perdus à 298°K sont dus à la variation d’entropie de la réaction. Une élévation de température de la pile va faire croître ce paramètre entropique mais elle va faire aussi décroître les résistances internes ioniques du système qui va améliorer le rendement électrique en particulier à fort courant. La plage courante de bon fonctionnement des piles à combustibles se situe entre 60 et 80°C.
Un tel schéma explique pourquoi il est intéressant et même indispensable de mettre une batterie en tampon avec la pile pour assurer les pointes de courant (accélération du véhicule) pour éviter les rendements trop faibles. Elle assure par ailleurs la récupération d’énergie au freinage.
Remarque: nous ne parlons ici que de purs rendements électrochimiques en dehors des indispensables circulations de liquides et de gaz et des régulations de températures qui vont consommer de l’énergie.(LIRE pour une approche de bilan global)
Remarque: dans le cas d’un accumulateur Ni-Cd la réaction de charge étant endothermique le potentiel de chaleur nulle est également au dessus du potentiel d’équilibre. On peut refroidir ce type d’accumulateur en le chargeant à faible courant. Dans le cas d’un accumulateur Ni-MH c’est l’inverse la charge est exothermique, l’accumulateur chauffe dès qu’on le met en charge. Dans le cas des accumulateurs Li-Ion les phénomènes thermiques sont beaucoup plus complexes et varient souvent en fonction de l’état de charge de l’accumulateur.
Une PAC utilisée en application stationnaire est une complexe usine à gaz qui partant de gaz naturel produit par reforming de l’hydrogène en émettant du CO2 (LIRE). Son fonctionnement global produisant beaucoup plus de chaleur que d’électricité c’est la quantité de chaleur consommée par le foyer qui détermine la taille de la PAC et non pas la consommation électrique. En application embarquée l’hydrogène, venant du reforming industriel de gaz, est comprimé dans une ou plusieurs bouteilles en matériau composite et la chaleur générée par la pile est perdue. Seule la partie électrique est utilisable, hormis la fonction chauffage de la cabine du véhicule.
Tout cela n’annonce pas une future et imminente révolution dans les transports, les solutions PAC se heurtant à la solution 100% électrique sur batterie, à la mise en place d’un réseau de distribution d’hydrogène, à l’obtention d’hydrogène à bon compte sans émissions de CO2, aux prix délirants d’une unité en ordre de marche. Des détails!
Le 22 Décembre 2008.
–
Laisser un commentaire