 A la New York State Recycling Conference, N. Neithalath a rappelé que le deuxième produit le plus consommé après l’eau dans le monde… c’est le béton.
A la New York State Recycling Conference, N. Neithalath a rappelé que le deuxième produit le plus consommé après l’eau dans le monde… c’est le béton.
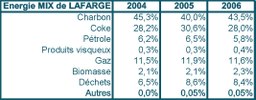
Aujourd’hui le monde consomme, annuellement, 12 milliards de tonnes de béton. Bien sûr, c’est la Chine qui fait croître le plus la consommation. Le béton est un excellent produit, mais il contient sa part de pollution émise lors de l’élaboration du ciment. L’extraction et la fabrication de ciment participent pour environ 7% des émissions de CO2 dans le monde. C’est considérable, c’est trois fois plus environ que les émissions de CO2 de l’aviation civile et militaire mondiale, par exemple. Il y a là un champ d’action dans lequel les ressources énergétiques renouvelables pourraient s’appliquer largement pour alimenter les fours rotatifs portés à 1500°C. Le Groupe Lafarge affirme que près de 11% de l’énergie consommée dans ses usines provient de ressources alternatives, dont 70% en Allemagne et 33% en France. Celà signifie que c’est beaucoup plus faible ailleurs. Son objectif est de faire croître cette part à 14% en 2010. C’est bien lent et mériterait d’être plus aidé et accéléré, partout dans le monde.

Laisser un commentaire